-
【 通用名称 】
盐酸阿扎司琼注射液
-
【 商 标 名 】
欧力克
-
【 产品用途 】
用于预防和治疗细胞毒类药物化疗所致的恶心、呕吐。
-
【 规 格 】
2ml:10mg。
-
【 包 装 】
5支/盒。玻璃安瓿瓶包装。
-
【 批准文号 】
国药准字H20113046
-
【 说明书 】
|
【
药品名称
】
|
通 用 名:盐酸阿扎司琼注射液 英文名称:Azasetron Hydrochloride Injection 汉语拼音: Yansuan Azasiqiong Zhusheye |
||||||||||||||||||||||||||||||||
|
【
成份
】
|
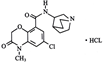
本品主要成分为盐酸阿扎司琼,化学名称为:(±)N-[1-氮杂双环(2,2,2)辛-3-基]-6-氯-4-甲基-3-氧代-3,4-二氢-2H-1,4-苯并噁嗪-8-甲酰胺盐酸盐。 化学结构式:
分子式:C17H20ClN3O3·HCl 分子量:386.28 辅料:乙二胺四乙酸二钠、注射用水。 |
||||||||||||||||||||||||||||||||
|
【
性状
】
|
本品为无色或几乎无色的澄明液体。 |
||||||||||||||||||||||||||||||||
|
【
适应症
】
|
用于预防和治疗细胞毒类药药物化疗所致的恶心、呕吐。 |
||||||||||||||||||||||||||||||||
|
【
规格
】
|
2ml:10mg。 |
||||||||||||||||||||||||||||||||
|
【
用法用量
】
|
每日一次,一次10mg(1支),用适量生理盐水稀释后,于化疗前30分钟缓慢静脉注射。若上述剂量未达到满意疗效,可继续静脉注射10mg。每日最大使用剂量为20mg。 |
||||||||||||||||||||||||||||||||
|
【
不良反应
】
|
根据国外文献报道,在可评估安全性的2971名患者中,有120(4%)名患者发生211次不良反应。副作用主要表现为头痛(0.9%)、发热(0.3%)、荨麻疹(0.3%)和眩晕(0.3%)。 1.临床重要不良反应 休克、过敏性休克(发生率不详,症状为感觉胸闷、呼吸困难、眩晕、面部潮红、水肿、紫绀、低血压等)。 2.其它不良反应
|
||||||||||||||||||||||||||||||||
|
【
禁忌
】
|
1.对本类药物(5-HT3受体拮抗剂)及本品过敏者禁用。2.胃肠道梗阻者禁用。 |
||||||||||||||||||||||||||||||||
|
【
注意事项
】
|
1.本品遇光易分散,应注意避光保存,并在启封后立即使用。 3.本品仅适用于使用抗癌药物所致的恶心、呕吐。当每日20mg仍无法获得满意疗效时,应考虑采用其他抑制呕吐的药物。 4.使用前应仔细检查,如有下列情况之一者,切勿使用:(1)药液浑浊;(2)瓶身或瓶口有细微破裂;(3)有棉絮状菌丝团;(4)封口松动。 |
||||||||||||||||||||||||||||||||
|
【
孕妇及哺乳期妇女用药
】
|
1.动物试验证明,大鼠在大剂量(约为临床剂量的500倍)使用本品后,将导致胎儿胎盘重量减小,雄性胎儿肾脏重量增加。因此,仅在评估孕妇用药利大于弊的情况下,方可使用。 |
||||||||||||||||||||||||||||||||
|
【
儿童用药
】
|
尚未确定儿童用药的安全性。 |
||||||||||||||||||||||||||||||||
|
【
老年用药
】
|
盐酸阿扎司琼主要由肾脏排泄,鉴于老年患者肾脏功能降低,体内血药浓度可维持在较高水平,并由此导致头痛、眩晕等症状的发生,因此,应根据患者的实际情况,调整给药剂量。若发生任何不良反应,则应停止给予额外剂量,并且在下次使用时相应减少剂量。 |
||||||||||||||||||||||||||||||||
|
【
药物相互作用
】
|
1.不宜与碱性注射液(呋喃苯胺酸、甲氨蝶岭、氟尿嘧啶、吡咯他尼或鬼臼乙叉苷)混用。 2.与鬼臼乙叉苷或氟氧头孢钠配伍时,有可能降低本剂的含量,因此配伍后应在6小时内使用。
|
||||||||||||||||||||||||||||||||
|
【
药物过量
】
|
未进行该项试验且无可靠参考文献。 |
||||||||||||||||||||||||||||||||
|
【
药理毒理
】
|
1.药理作用 盐酸阿扎司琼为选择性5-HT3受体拮抗剂,对顺铂等抗癌药引起的恶心及呕吐有明显的抑制作用。动物研究表明,盐酸阿扎司琼对大鼠大脑皮质5-HT3受体亲和力比甲氧氯普胺约强410倍,为恩丹西酮的2倍,与格拉司琼基本相同。 2.毒理研究 (1)重复给药毒性:本品大鼠静脉注射液给药,10mg/kg和60mg/kg组动物出现进食量和体重增加及可逆性的心脏、肝脏、脑和肾上腺重量增加,犬连续静脉注射给药3个月,剂量达30mg/kg时,给药后即刻出现呕吐和流涎等症状。 (2)生殖毒性:大鼠妊娠前及妊娠初期给药剂量60mg/kg时,对母体动物的生殖功能及胎仔发育未见明显影响。大鼠器官形成期,静脉注射剂量达100mg/kg时,出现胎盘重量(F1)减少及雄性新生鼠(F1)的肾脏及肾上腺重量增加,但对母体、胎仔(F1和F2)及新生鼠(F1)的发育及功能均未表现出明显影响。家兔静脉注射给药剂量达0.3mg/kg时,出现母体动物摄食量减少;剂量达到3.0mg/㎏时,出现胎仔发育轻度抑制;达30mg/kg时,出现胎仔死亡率轻度增加,但未出现致畸性。大鼠围产期静脉注射给药达100mg/kg时,对母体动物无明显影响,但雄性仔鼠出现肝脏重量稍减轻。动物研究结果已表明,本品可经大鼠乳汁分泌,故哺乳期妇女使用本品期间应停止哺乳。 (3)遗传毒性:本品Ames试验和小鼠微核试验结果均为阴性,但体外培养细胞染色体畸变试验结果发现染色体结构异常。 |
||||||||||||||||||||||||||||||||
|
【
药代动力学
】
|
血浆药物浓度 健康男性志愿者单剂量静脉注射盐酸阿扎司琼10mg后,3分钟的血浆中原形药的浓度为190.5ng/ml,药动学过程呈线性。血浆中可见原形药物及N-氧化产物,未见脱甲基阿扎司琼。本品呈双相消除,α相和β相的消除半衰期分别是0.06-0.13h和4.1-4.3h。药物参数见表1. 表1 健康男性志愿者静脉给予10mg盐酸阿扎司琼药动学参数(n=6)
顺铂引起呕吐的恶心肿瘤患者,静脉注射盐酸阿扎司琼10mg后,呈双相消除,终末半衰期为7.3±1.2h,AUC为353.7±55.2 ng·h/ml。药代参数见表2. 表2患者静脉给予10mg盐酸阿扎司琼药动学参数(n=6)
代谢与排泄 健康男性志愿者静脉注射盐酸阿扎司琼10mg,尿中排泄的原形药、N-氧化产物及脱甲基产物分别为给药量的64.9-66.8%、0.2-0.3%及4.1-6.4%。主要排泄途径为尿液。使用顺铂引起呕吐的癌症患者,静脉给予盐酸阿扎司琼10mg,24h内的尿中原形药累积排泄率为64.3±15.0%,与健康志愿者基本相同。 血浆蛋白结合率 体外血浆蛋白结合率为31.2%。 动物体内组织分布 大鼠静脉给予14C标记的盐酸阿扎司琼,15分钟放射性高的组织为肝脏、肺和肾。放射性随后快速从上述组织中消失,给药24小时后,上述组织中的放射性仅为给药15分钟的1/10。 怀孕大鼠静脉给予14C标记的盐酸阿扎司琼,放射性快速转移到胎盘和胎儿组织,然而,给药24小时后,胎盘组织中放射性仅为峰值的1/250,而胎儿组织中放射性低于最低检测限。放射性可转移至乳汁,但消失很快,给药30小时后,乳汁中放射性仅为峰值的1/500。 |
||||||||||||||||||||||||||||||||
|
【
贮藏
】
|
遮光,密闭保存。 |
||||||||||||||||||||||||||||||||
|
【
包装
】
|
5支/盒。玻璃安瓿瓶包装。 |
||||||||||||||||||||||||||||||||
|
【
有效期
】
|
24个月。 |
||||||||||||||||||||||||||||||||
|
【
批准文号
】
|
国药准字H20113046 |
||||||||||||||||||||||||||||||||
|
【
执行标准
】
|
国家药品标准WS1-(X-334)-2004Z-2014 |
||||||||||||||||||||||||||||||||
|
【
药品上市许可持有人
】
|
企业名称:朗天药业(湖北)有限公司 地 址:湖北省黄石市下陆区大泉路120号 |
||||||||||||||||||||||||||||||||
|
【
生产企业
】
|
企业名称:朗天药业(湖北)有限公司 地 址:湖北省黄石市下陆区大泉路120号 电话号码:0714-6354581,0714-6350072 传真号码:0714-6354581 邮 编:435003 网 址:http://www.langtian.cn |